2024年5月29日,上海藥品監(jiān)督管理局發(fā)布《上海市醫(yī)療器械注冊(cè)人委托生產(chǎn)現(xiàn)場(chǎng)核查常見問題分析》,一起來看具體內(nèi)容����。
一��、檢查概況
2021-2023年�����,上海器審中心實(shí)施醫(yī)療器械注冊(cè)人委托生產(chǎn)現(xiàn)場(chǎng)檢查共計(jì)189家��,涉及160種醫(yī)療器械產(chǎn)品����,共開具1055項(xiàng)規(guī)范不合格項(xiàng)。其中�,2021年核查23家企業(yè),2022年核查49家�����,2023年核查117家�。近年來,醫(yī)療器械注冊(cè)人委托生產(chǎn)數(shù)量呈現(xiàn)爆發(fā)增長趨勢(shì)��,三年內(nèi)二類產(chǎn)品數(shù)量增長343%�����,三類產(chǎn)品數(shù)量增長557%(圖1)。
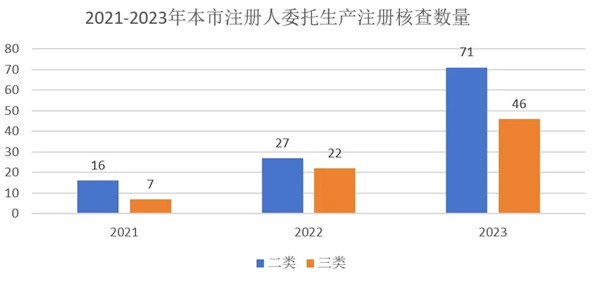
圖1 2021-2023年本市委托生產(chǎn)注冊(cè)核查數(shù)量
在開展委托生產(chǎn)的產(chǎn)品中����,無源與植入產(chǎn)品共104種,占比65%�,多為有源主機(jī)的附件。不同種類的產(chǎn)品委托生產(chǎn)數(shù)量也呈現(xiàn)增長趨勢(shì)���,其中有源產(chǎn)品的委托生產(chǎn)數(shù)量增長了約2倍�,無源與植入產(chǎn)品的委托生產(chǎn)三年間增長了3倍����,體外診斷試劑產(chǎn)品三年間實(shí)現(xiàn)了“從零到多”的突破(圖2)。
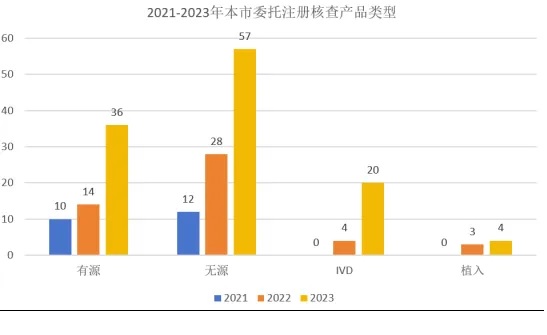
二���、受托生產(chǎn)地域分布情況
本市開展的委托生產(chǎn)現(xiàn)場(chǎng)檢查分以下兩種情況:(1)上海注冊(cè)人委托外省市生產(chǎn)企業(yè)生產(chǎn)(圖3)����;(2)外省市注冊(cè)人委托上海生產(chǎn)企業(yè)生產(chǎn)(圖4)��。委托生產(chǎn)具有明顯的聚集效應(yīng)�����,不管是外省注冊(cè)人還是外省受托生產(chǎn)企業(yè)�,多集中分布于長三角一帶。尤其是有源類產(chǎn)品�,外省受托企業(yè)一般分布在長三角與廣東等電子行業(yè)較為發(fā)達(dá)的地區(qū)。
三�����、委托生產(chǎn)現(xiàn)場(chǎng)檢查不合格項(xiàng)情況
2021-2023年本市醫(yī)療器械注冊(cè)人委托生產(chǎn)現(xiàn)場(chǎng)核查中共發(fā)現(xiàn)不符合項(xiàng)1055條���,涉及《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及附錄條款1049條�����,《上海市醫(yī)療器械注冊(cè)人委托生產(chǎn)質(zhì)量管理體系實(shí)施指南》不符合6條����,其中重點(diǎn)項(xiàng)297項(xiàng)(占比28.1%)���,一般項(xiàng)758項(xiàng)(占比71.8%)�����。
四��、常見不合格項(xiàng)分析
2021年以來�,醫(yī)療器械注冊(cè)人委托生產(chǎn)體系現(xiàn)場(chǎng)檢查發(fā)現(xiàn),委托生產(chǎn)質(zhì)量協(xié)議主要存在以下方面問題:(1)委托生產(chǎn)質(zhì)量協(xié)議未明確注冊(cè)申請(qǐng)人對(duì)受托方進(jìn)行采購控制����、生產(chǎn)過程和質(zhì)量檢驗(yàn)?zāi)芰Φ确矫娴谋O(jiān)督方式、監(jiān)控頻次和標(biāo)準(zhǔn)�����。(2)委托生產(chǎn)質(zhì)量協(xié)議中未對(duì)采購�、供應(yīng)商管理(包含供應(yīng)商變更)等職責(zé)進(jìn)行分工和描述。(3)委托生產(chǎn)質(zhì)量協(xié)議中��,缺少雙方在生產(chǎn)�����、檢驗(yàn)等產(chǎn)品實(shí)現(xiàn)過程中的分工�、職責(zé)描述。(4)委托生產(chǎn)質(zhì)量協(xié)議未區(qū)分生產(chǎn)放行和上市放行���;(5)雙方簽訂的委托生產(chǎn)質(zhì)量協(xié)議中��,未對(duì)投訴��、不良事件的處置流程�����、雙方職責(zé)做出規(guī)定����。結(jié)合《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及其附錄�����,2021年以來注冊(cè)人受托生產(chǎn)現(xiàn)場(chǎng)檢查的不合格項(xiàng)主要集中在設(shè)計(jì)開發(fā)����、采購、生產(chǎn)管理與質(zhì)量控制部分��,占比為76.7%�����。除“上海器審”微信公眾號(hào)已發(fā)布的現(xiàn)場(chǎng)核查共性問題外�����,注冊(cè)人委托生產(chǎn)還存在如下問題:
1、設(shè)計(jì)開發(fā)
(1)對(duì)于實(shí)際由受托企業(yè)完成設(shè)計(jì)開發(fā)并將設(shè)計(jì)轉(zhuǎn)移至注冊(cè)人的情形�,設(shè)計(jì)轉(zhuǎn)移不充分(如:未將產(chǎn)品圖紙、工藝文件�����、檢驗(yàn)等設(shè)計(jì)文件轉(zhuǎn)移至注冊(cè)人)����,或雙方未簽訂設(shè)計(jì)轉(zhuǎn)移相關(guān)協(xié)議,或未在文件中規(guī)定注冊(cè)人對(duì)設(shè)計(jì)轉(zhuǎn)移產(chǎn)品的設(shè)計(jì)控制要求����;(2)注冊(cè)人未將工藝控制點(diǎn)轉(zhuǎn)移給受托企業(yè),如部分物料在進(jìn)貨時(shí)需要進(jìn)行輻照滅菌����,但注冊(cè)人未對(duì)輻照滅菌開展研究,也未在設(shè)計(jì)文檔中體現(xiàn)該流程�����;(3)設(shè)計(jì)輸出文件轉(zhuǎn)移不全,如未將作業(yè)指導(dǎo)書���、使用說明書����、標(biāo)簽樣張等轉(zhuǎn)移給受托企業(yè)�,或未保存受托方接收的記錄��。
2���、采購
實(shí)際采購��、供應(yīng)商評(píng)價(jià)等行為與雙方簽訂的委托生產(chǎn)質(zhì)量協(xié)議不符���。協(xié)議規(guī)定A類物料的供應(yīng)商評(píng)價(jià)由注冊(cè)人和受托生產(chǎn)企業(yè)共同完成,但實(shí)際僅查見受托生產(chǎn)企業(yè)的供應(yīng)商評(píng)價(jià)記錄�;協(xié)議規(guī)定供方變更需由注冊(cè)人批準(zhǔn),但實(shí)際未查見注冊(cè)人的批準(zhǔn)記錄����;協(xié)議規(guī)定由受托方開展采購,但采購記錄顯示采購方不是受托企業(yè)等����。
3�����、生產(chǎn)管理
(1)注冊(cè)人對(duì)受托企業(yè)的審核評(píng)估有效性不足���,如現(xiàn)場(chǎng)查見受托企業(yè)無菌檢測(cè)室/微生物限度間/陽性對(duì)照間共用同一套凈化系統(tǒng)、凈化車間部分頂角圓弧帶開裂�����、脫落等問題�;(2)注冊(cè)人未對(duì)受托企業(yè)制定的作業(yè)指導(dǎo)書進(jìn)行評(píng)審和確認(rèn);(3)產(chǎn)品的滅菌批號(hào)與注冊(cè)人制定的產(chǎn)品編碼規(guī)則不符�����。
4���、質(zhì)量控制
(1)受托企業(yè)在檢驗(yàn)時(shí)未按照注冊(cè)人輸出的檢驗(yàn)規(guī)程開展�;(2)受托企業(yè)在生產(chǎn)放行時(shí)未對(duì)由注冊(cè)人承擔(dān)的部分檢驗(yàn)項(xiàng)目結(jié)果進(jìn)行確認(rèn)���;(3)未按照協(xié)議要求提供注冊(cè)人授權(quán)受托企業(yè)生產(chǎn)放行的授權(quán)書�,未按照協(xié)議的要求開展放行等,與委托生產(chǎn)質(zhì)量協(xié)議不符�����。